뇌의 흥분성 신경세포에서 이노시톨 대사효소 제거
공포기억의 소거 현상이 조절되는 것을 규명
공포기억에 무덤덤해지도록 우리 뇌를 조절하는 효소가 발견되었다. 김세윤 교수(KAIST) 연구팀이 뇌의 흥분성 신경세포에서 이노시톨 대사효소를 제거함으로써 공포기억의 소거 현상이 조절되는 것을 규명했다고 한국연구재단은 밝혔다. 이 연구는 존스 홉킨스 의대, 뉴욕대, 컬럼비아 의대와의 국제공동연구로 진행되었다.
‘기억은 어떻게 만들어지고 지워지는지’는 현대 신경생물학의 핵심주제이다. 특히 인간의 정신건강과 생활에 심각한 문제를 초래하는 공포증, 외상후 스트레스 장애 등을 이해하고 치료하기 위해 공포기억의 소거* 과정은 심층연구가 필요하다.
* 공포기억의 소거(extinction of fear memory) : 단순한 기억의 소멸이라기보다 공포자극에 동기화된 기억을 억제하는 또다른 학습으로 여겨진다.
연구팀은 뇌의 흥분성 신경세포에 발현되는 이노시톨 대사효소가 공포기억의 소거 조절에서 핵심 역할을 담당한다는 것을 밝혔다. 연구팀이 생쥐의 흥분성 신경세포에서만 특이적으로 이노시톨 대사효소를 제거하자, 공포기억의 소거 반응이 촉진되었다. 특히 이 효소가 제거된 생쥐의 편도체에서는 공포기억의 소거 반응을 전달하는 신호전달계의 활성화가 동반됨이 확인되었다.
이노시톨 대사효소는 음식으로 섭취되거나 생체 내에서 합성된 이노시톨(포도당 유사물질)을 인산화해주는 효소이다. 이번 연구를 통해 이노시톨 대사가 기존에 알려진 세포의 성장, 신진대사 뿐 아니라 뇌기능 조절에서도 중요한 기능을 한다는 점을 알 수 있다.
김세윤 교수는 “큰 사고나 트라우마로 인한 외상후 스트레스 장애, 공포증 등 심각한 뇌질환들에 대한 이해와 치료 타겟을 확립하는 데 기여할 것으로 기대된다”라고 연구 의의를 설명하며, “이노시톨 대사효소의 신경계 신호전달 조절에 관한 분자적 작용과정 연구를 지속적으로 진행할 것”이라고 밝혔다.
이 연구 성과는 과학기술정보통신부·한국연구재단 뇌과학원천기술개발사업, 기초연구사업(선도연구센터)의 지원으로 수행되었다. 권위 있는 세계적 학술지 ‘PNAS’에 1월 28일 논문으로 게재되었다.
◇논문명
Inositol polyphosphate multikinase mediates extinction of fear memory
◇저 자
김세윤 교수(교신저자, KAIST), 솔로몬 스나이더 교수(Solomon H. Snyder) (교신저자, 존스 홉킨스 의대), 에릭 클란 교수(Eric Klann)(교신저자, 뉴욕대), 엠마누엘라 산티니 교수(Emanuela Santini)(교신저자, 컬럼비아 의대), 박진아 박사(제1저자, KAIST), 프란체스코 롱고 박사(Francesco Longo) (뉴욕대), 박승주(KAIST), 이슬기(KAIST), 배미현 박사(IBS), 리차 티아기 박사(Richa Tyagi)(존스 홉킨스 의대), 한진희 교수(KAIST)
□ 연구의 주요내용
1. 연구의 필요성
○ 생쥐에게 강한 소리자극과 전기자극을 동기화하면 매우 강력하게 동포기억이 학습된다. 이후 전기자극 없이 소리자극만 반복적으로 제시되면 공포기억에 대한 반응이 서서히 줄어드는데, 이를 ‘공포기억의 소거(extinction of fear memory)’라고 한다. 공포기억의 소거는 단순한 기억 소멸보다는 공포자극에 동기화된 기억을 억제하는 또 다른 학습으로 받아들여진다. 공포기억의 소거를 매개하는 분자들은 과연 무엇인가? 이 질문은 신경과학계 및 관련 의학계의 중요한 연구주제임에도 불구하고 어떠한 유전자들에 의하여 조절되는가에 대한 우리의 지식은 매우 부족하다. 공포기억의 소거에 알려진 분자들로는 histone deacetylase, protein kinase A, calcineurin, p85 S6 kinase 1(S6K1)가 대표적이다.
○ 공포(fear), 트라우마(trauma) 또는 극심한 스트레스(재난, 사고 등)와 같은 충격적 경험들을 통해 발생하는 외상후 스트레스 장애(PTSD)는 인간의 삶의 질과 건강을 위협하는 정신질환으로 미래‧현대사회에서 해결이 필요한 대표적 의료문제 중 하나이다. 갈수록 증가하는 상기 정신질환을 효과적으로 제어하고 치료하기 위한 뇌과학적 기초지식과 신규 약물 타겟 발굴에 공포기억 소거 연구가 활용된다.
○ 이노시톨은 포도당 유사물질로서, 우리 신체에서 일부 합성되기도 하지만 음식으로 충분히 섭취되어야 하는 중요 영양분이다. 이노시톨은 세포의 지질막을 구성하고, 인산화된 형태로 세포의 각종 활성을 조절한다. 이러한 이노시톨 대사에서 가장 핵심적 역할을 하는 대표적 효소인 IPMK(Inositol polyphosphate multikinase) 단백질은 동물세포의 성장과 에너지 대사조절 등에 필수적인 역할을 담당한다. 그러나 IPMK 효소의 뇌기능에 대한 보고는 거의 전무하다.
2. 연구내용
○ 특정 신경세포에서 원하는 유전자를 제거(녹아웃)하여 IPMK 효소에 의한 뇌기능 조절여부를 분석했다. 신경세포 중에서도 흥분성 신경세포(glutamatergic excitatory neuron)에서만 특이적으로 IPMK 녹아웃을 유도하였고 다양한 행동‧생화학적 분석을 실시하였다.
○ 흥분성 뉴런에서만 IPMK 효소가 제거된 생쥐군은 대조군에 비하여 뇌의 구조나 기본적인 운동성 조절능력 등에 있어서 차이를 보이지 않았다. 대표적인 학습 테스트인 Y-미로 검사, 모리스 수조 미로 검사, 공포 조건화 반응에 있어서 모두 IPMK 녹아웃 생쥐와 대조군간의 차이는 검출되지 않았다. 그러나 공포기억의 정상적 학습 이후 소거 조건(전기자극없이 소리자극만 주어지는 소거학습 테스트)에서는 IPMK 녹아웃 생쥐에서 매우 현저하고 빠른 공포기억 소거반응을 보였다.
○ 흥분성 뉴런에서만 IPMK 효소가 제거된 생쥐의 뇌에서 어떠한 신호조절장애가 발생하였는지를 분석한 결과, 대뇌 변연계에 존재하는 편도체에서의 p85 S6K1 신호전달 단백질의 활성이 특이적으로 증가되어 있음을 동정하였다. 이는 편도체에서의 IPMK 효소에 의한 p85 S6K1 단백질의 정교한 활성조절이 공포기억의 소거의 중요한 현상임을 강력하게 시사한다. 편도체 조직 외에도 해마조직에서의 전기생리학적 분석에 따르면, IPMK 녹아웃 생쥐는 대조군보다 훨씬 장기 강화(long-term potentiation) 현상이 증가함을 밝혔다. 이는 공포기억의 핵심 신경망에서의 IPMK 효소 의존적인 시냅스 가소성 조절을 시사하는 결과로서 향후 추가연구를 수행하여 규명할 부분이다.
3. 연구성과/기대효과
○ 이 연구를 통하여 이노시톨 대사의 핵심인 IPMK 효소가 공포기억의 소거반응을 특이적으로 조절하는 신규 조절물질임을 최초로 발굴하였고 이는 이노시톨 생합성 대사분야에서의 여태껏 밝혀지지 않았던 새로운 생리학적 기능임과 동시에 공포기억의 조절을 매개하는 새로운 핵심인자의 발견을 의미한다.
○ 각종 트라우마 및 극심한 스트레스등에 의하여 후천적으로 획득된 공포기억은 심할 경우 외상후 스트레스 장애 및 공포증과 같은 현대 사회의 심각한 정신 질환들을 유발한다. 이에 공포기억의 소거현상에 대한 기초적인 뇌과학 지식의 이해와 더불어 치료 타겟을 확립하는 데에 기여할 것으로 기대된다.
그림 설명
 |
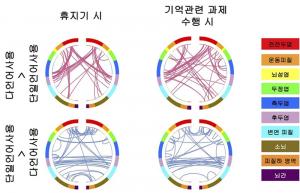
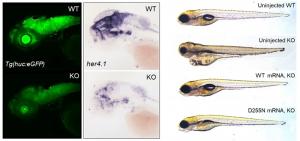
(그림1) 이노시톨 대사효소(IPMK) 제거된 생쥐의 공포기억 소거 증진
유전자 녹아웃 기술을 이용하여 생쥐의 흥분성 신경세포 특이적으로 이노시톨 대사효소(IPMK)를 제거하였고(상단), 그 결과 소리 및 전기자극으로 학습된 공포기억이 소거되는 능력이 현저하게 향상되었다(하단).
 |
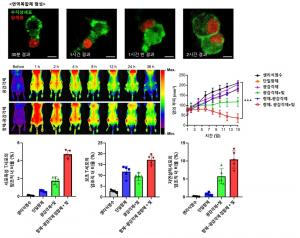
(그림2) 이노시톨 대사효소 녹아웃에 따른 뇌 신호전달 및 생리학적 변화
이노시톨 대사효소(IPMK) 녹아웃 생쥐의 편도체에서는 p85 S6K1 신호전달이 증가했다(상단).
또한 해마의 전기생리학적 분석에 따르면 이노시톨 대사효소(IPMK) 녹아웃에 의한 시냅스의 후기-장기강화 현상이 더욱 강하게 유도되었다(하단 좌측결과).
연구 이야기
- 연구를 시작한 계기나 배경은?
이노시톨이 충분히 음식으로부터 공급되지 않는 경우 정신질환이 야기되는 등, 이노시톨 대사와 뇌활성 조절에 대한 오래된 보고들이 있었으나 분자적 수준의 연구는 매우 부족하다. 2000년대에 들어서서 이노시톨 대사의 핵심 효소들이 클로닝되었고 연구를 위한 생쥐모델들이 하나씩 구축되었다. 여기에 힘입어 이노시톨 대사에서 가장 중요한 효소인 IPMK의 뇌기능 조절여부를 이해하고자 연구를 시작하였고, 예상치 못했지만 공포기억의 소거 조절 기능을 발견했다.
- 연구 전개 과정에 대한 소개
IPMK 효소의 신경세포 특이적 녹아웃을 위해 솔로몬 스나이더 교수(존스 홉킨스 의대), 에릭 클란 교수(뉴욕대), 엠마누엘라 산티니 교수(콜럼비아 의대), 김세윤 교수(카이스트 생명과학과) 연구팀에서 국제공동연구를 진행했다. 생쥐모델의 확보 후 여러 연구단의 긴밀한 협력과 토론이 있었다. 무엇보다도 IPMK 녹아웃 생쥐의 기억‧인지 기능을 분석하는 다양한 행동연구에서 많은 시간과 연구력이 투입되었다.
- 연구하면서 어려웠던 점이나 장애요소는 무엇인지? 어떻게 극복(해결)하였는지?
IPMK 녹아웃 생쥐에서 수행한 수많은 동물행동 분석 결과가 차이가 없다고 나타났다. 오랜 기간의 분석에서 유의미한 결과를 얻지 못했지만, 마침내 공포기억의 소거반응에서 장애를 발견해냈다. 인내심을 가지고 발굴한 성과이기에 더욱 뜻깊고 소중하다.
- 이번 성과, 무엇이 다른가?
이노시톨 및 대사는 세포의 성장 및 신진대사 조절과 관련해 활발히 연구된 반면, 뇌기능 조절에 관련해서는 연구결과가 매우 부족하다. 이노시톨 생합성 대사의 새로운 중요성이 발굴되었다는 점, 그리고 아직 미지의 영역이나 다름없는 공포기억 소거 조절의 새로운 핵심인자를 밝혔다는 점이 의미가 크다.
- 실용화된다면 어떻게 활용될 수 있나? 실용화를 위한 과제는?
IPMK 효소를 이용해 정교한 기억조절을 기대하기에는 아직 시기상조이다. 그렇지만 IPMK 및 이노시톨 대사체들이 향후 뇌기능 제어 및 뇌질환 진단‧치료에 활용될 가치가 매우 크다.
- 꼭 이루고 싶은 목표나 후속 연구계획은?
이 연구에서 구축한 IPMK 녹아웃 생쥐모델을 활용하여 아직 도전하지 못한 뇌기능의 다양한 영역들(치매, 중독)과의 연관성을 확인해보고 특히 분자적 수준에서 IPMK 효소의 작용 기전을 밝히는 기초연구를 추가로 수행하고자 한다.
연구자 소개
김세윤 교수, 교신저자
 |
1. 인적사항
○ 소 속 : 한국과학기술원 생명과학과
○ 전 화 : 042-350-2625
○ e-mail : seyunkim@kaist.ac.kr
2. 학력
○ 2007년 미국 존스 홉킨스 의대 박사 (생화학)
○ 2007 ~ 2011 미국 존스 홉킨스 의대 (신경과학, 박사후 연구원)
3. 경력사항
○ 2012 ~ 현재 한국과학기술원 생명과학과 조교수, 부교수
○ 2012 ~ 2013 포스코 청암재단 신진교수펠로
○ 2013 ~ 현재 삼성미래기술육성재단 기초과학-생명과학분야 연구단 선정
○ 2007 Harold Weintraub Award (Fred Hutchinson Cancer Center)
○ 2007 미국 존스 홉킨스 의대 젊은 과학자상
○ 2001 ~ 2003 대한민국 국비유학 장학생
4. 전문분야 정보
○ 생화학 (이노시톨 대사 신호전달연구)
5. 연구지원 정보
○ 2013 ~ 2018 과학기술정보통신부‧한국연구재단 뇌과학원천기술개발사업
○ 2018 ~ 현재 과학기술정보통신부‧한국연구재단 기초연구사업(선도연구센터)
박진아 박사, 제1저자
 |
1. 인적사항
○ 소 속 : 한국과학기술원 생명과학과
○ 전 화 : 042-350-2665
○ e-mail : nagajina@kaist.ac.kr
2. 학력
○ 2012년 한국과학기술원 생명과학과 학사
○ 2018년 한국과학기술원 생명과학과 박사
○ 2018 ~ 현재 한국과학기술연구원 (신경과학, 박사후 연구원)
3. 경력사항
○ 2019년 2월 한국과학기술원 생명과학기술대학 우수논문상
4. 전문분야 정보
○ 신경과학/생화학 (이노시톨 대사효소의 신호전달 및 신경계 기능연구)
한국연구재단 홍보실 제공
노벨사이언스 science@nobelscience.co.kr